37. 살균소독력시험법
분석원리 : 본 시험방법은 기구등의 살균소독제의 살균소독력 유무를 측정하는 방법으로 세균현탁액시험법, 세균표면시험법, 포자현탁액시험법이 있으며, 별도의 규정이 없는 한 세균현탁액시험법으로 측정한다.
살균소독력의 정의 : 기구등의 살균소독제에 대하여 규정된 조건에서 규정된 시험균의 초기균수(cfu/mL)에 대한 생균수(cfu/mL) 감소율(%)을 말한다.
가. 세균현탁액시험법
1) 시험용액의 조제
시험용액은 검체에 표시된 사용농도보다 1.25배 높게 경수(바. 시액 ②)로 희석하여 제조한다. 제조된 시험용액은 바로 사용하여야 하며, 최대 2시간을 초과하여 사용할 수 없다. 단, 희석하지 않고 그대로 사용하는 검체의 경우에는 원액을 그대로 사용한다.
2) 시험균주
다음의 2가지 시험균주를 표준균주로 사용한다.
- Escherichia coli ATCC 10536 또는 Escherichia coli ATCC 11229
- Staphylococcus aureus ATCC 6538
다만, 상기 표준균주 외에 다음과 같은 시험균주를 선택하여 추가할 수 있다.
- Bacillus cereus ATCC 21772
- Vibrio parahaemolyticus ATCC 27969
- Salmonella ctyphimurium ATCC 13311
- Listeria monocytogenes ATCC 19111 (또는 Listeria monocytogenes ATCC 19115)
3) 시험균주의 활성배양
시험균주를 TSA배지(마. 배지 ①)에 도말하여 36±1℃에서 18~24시간 배양한다. 이를 1차배양이라 하며, 같은 방법으로 2차 배양을 한다. 시험에서는 2차 배양된 시험균주를 사용한다. 다만, 추가 시험균주 중 V. parahaemolyticus의 배양을 위해서는 염화나트륨이 2%가 되도록 조정한 TSB배지(마. 배지 ②) 10mL에 시험균 10μL를 접종하여 36±1℃에서 18~24시간 배양한다. 1차 배양이 완료되면 2차 배양을 염화나트륨이 2%가 되도록 조정한 TSB배지 100mL에 한다.
4) 시험균주 현탁액의 조제 및 계수
(1) 조제 : 상기 3)에 따라 2차 배양된 시험균을 백금이를 사용하여 트립톤생리식염수(바. 시약 ①) 10mL와 유리비드(라. 기구 및 재료 ①) 5g이 들어간 100mL 삼각플라스크에 옮긴다. 이때 시험균이 옮겨진 백금이를 트립톤생리식염수에 담그고 삼각플라스크의 벽면에 문질러 완전히 균괘가 떨어지도록 한 다음 3분간 교반기(라. 기구 및 재료 ②)를 이용하여 잘 섞는다. 이후 유리비드 안쪽의 현탁액을 취하여 다른 시험관으로 옮긴다. 트립톤생리식염수를 사용하여 생균수를 1.5X108 ~ 5.0X108 cfu/mL로 조정하하고 20±1℃의 항온수조(라. 기구 및 재료 ③)에 방치한 후 시험균주 현탁액으로 사용한다. 시험균주 현탁액은 제조 후 2시간 이내에 사용하여야 한다. 다만, 추가 시험균주 중 V. parahaemolyticus의 경우에는 상기 3)의 배양균을 멸균된 50mL 원심분리관에 넣고 원심분리기(라. 기구 및 재료 ④) 20℃, 5000Xg(6,000rpm)에서 5분간 원심분리하여 상등액을 조심스럽게 버린 후, 잔류된 균괘에 트립톤생리식염수 25mL를 첨가하여 10초간 진탕교반기를 이용하여 교반한다. 교반이 완료되면 다시 원심분리하여 상등액을 버린 후, 트립톤생리식염수 2mL를 첨가하여 균괘를 현탁시켜 둔다. 100mL 삼각플라스크에 트립톤생리식염수 10mL와 유리비드 5g을 넣고 미리 준비한 균 현탁액을 첨가하여 3분간 진탕교반기를 이용하여 잘 섞은 후 트립톤생리식염수를 사용하여 생균수를 1.5 ~ 5.0X108 cfu/mL가 되도록 조정하고 20±1℃의 항온수조에서 2시간 방치한 액을 시험균주 현탁액으로 한다.
(2) 계수 : 시험균주 현탁액을 트립톤생리식염수를 사용하여 10-6 과 10-7 으로 희석하고, 이 희석액을 1mL씩을 멸균 페트리접시(라. 기구 및 재료 ⑤) 2매에 각각 넣고 45±1℃로 유지한 TSA배지 약 15mL를 무균적으로 분주하고 잘 혼합하여 응고시킨다. 확산집락의 발생을 방지하기위하여 TSA배지 3~5mL를 가하여 중첩시킨다. 냉각응고된 페트리접시를 거꾸로 하여 36±1℃에서 48±2시간 배양한 후 다음의 계산식에 따라 시험균주 현탁액의 생균수(N)를 계수한다. 생균수의 계산은 15 ~ 300개의 집락을 생성한 페트리접시를 택하여 계산한다. 10-6 과 10-7의 희석배수에서 모두두 유효범위의 결과가가 나오면 다음의 식에 의하여 생균수를 산정한다. 하지만, 한 단계의 희석배수에서만 유효범위의 결과를 얻었을 경우에는 산술평균하고 희석배수를 곱하여 계산한다. 계산된 결과는 두 자리 유효숫자를 얻을 때까지 반올림하여 1.0과 9.9사이의 숫자를 10의 배수로 곱한 방식(예, 2.7 X 108 cfu/mL)으로 표시한다.
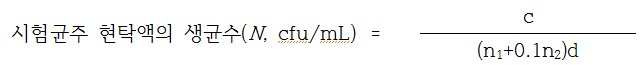 c : 페트리접시에서 계수된 집락수의 합
c : 페트리접시에서 계수된 집락수의 합
n1 : 10-6 희석에서 계수된 페트리접시의 수
n2 : 10-7 희석에서 계수된 페트리접시의 수
d : 첫 번째 희석액의 희석배수(10-6)
5) 시험균주 현탁희석액의 조제 및 계수
(1) 조제 : 상기 4)의 시험균주 현탁액을 트립톤생리식염수를 사용하여 생균수가 3.0 X 102 ~ 1.6 X 103 cfu/mL가 되도록 희석하여 조제한다.
(2) 계수 : 시험균주 현탁희석액을 트립톤생리식염수로 10배 희석하고 이 희석액 1mL씩을 멸균 페트리접시 2매에 각각 넣어 45±1℃로 유지한 TSA배지 약 15mL를 무균적으로 분주하여 냉각응고 시킨 후 TSA배지 3 ~ 5mL를 가하여 중첩시킨다. 냉각응고된 페트리접시를 거꾸로하여 36±1℃에서 48±2시간 배양한 후 생균수를 계수한다. 시험균주 현탁희석액의 생균수(Nv)는 다음의 계산식에 따라 산정한다. 이때 시험균주 현탁희석액의 생균수는 3.0 X 102 ~ 1.6 X 103 cfu/mL이어야 한다.
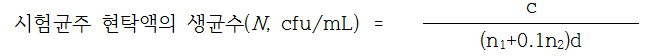 c : 페트리접시에서 계수된 집락수의 합
c : 페트리접시에서 계수된 집락수의 합
n : 계수된 페트리접시의 수
6) 시험조작
시험용액, 시험균주 현탁액, 시험균주 현탁희석액, 시액 및 물 등은 항온수조에서 20±1℃로 유지시킨다.
(1) 본시험
시험관(라. 기구 및 재료 ⑥)에 간섭물질 1mL와 시험균주 현탁액 1mL를 첨가하여 즉시 혼합하고 20±1℃의 항온수조에서 2분간 방치한다. 이 후 시험용액 8mL를 첨가하여 혼합하고 20±1℃의 항온수조에서 5분간 반응시킨다. 이 반응혼합액 1mL를 취하여 중화제 8mL와 물 1mL가 들어있는 시험관에 넣고 20±1℃의 항온수조에서 5분간 중화시킨다.
이 중화반응혼합액 1mL씩을 멸균 페트리접시 2매에 각각 넣고 상기 가. 4)와 같이 배양한다. 본 시험에서의 생균수(Na)를 상기 가. 5) (2)의 계산식에 따라 산정한다. 단, 원액을 사용하하는 검체는 시험용액을 9.8mL 첨가하고, 간섭물질과 시험균주 현탁액의 농도를 상기 사용한 농도보다 10배 높게 조제하여 각각 0.1mL씩 첨가하여 상기 시험조작과 동일하게 조작한다.
(2) 검증시험
검증시험에는 시험조건 검증시험, 중화제 독성 검증시험 및 희석중화 검증시험이 있으며, 이들 검증시험들은 상기 본시험과 같이 수행해야 한다.
① 시험조건 검증시험
시험관에 시험균주 현탁희석액 1mL와 간섭물질 1mL를 첨가하여 즉시 혼합하고 20±1℃의 항온수조에서 2분간 방치한다. 이후 경수 8mL를 첨가하여 혼합한 후 20±1℃의 항온수조에서 5분간 반응시킨다. 이 반응혼합액에서 1mL씩을 멸균 페트리접시 2매에 각각 넣고 상기 가. 4) (2)와 같이 배양한다. 시험조건 검증법에서의 생균수(A)를 다음의 계산식에 따라 산정한다. 이 때, 시험조건 검증시험의 생균수(A)는 시험균주 현탁희석액(Nv)에서 산정한 생균수의 0.05배수 이상이어야 한다.
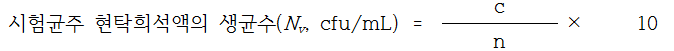
c : 페트리접시에서 계수된 집락수의 합
n : 계수된 페트리접시의 수
② 중화제 독성 검증시험
시험관에 시험균주 현탁희석액 1mL, 중화제 8mL 및 증류수 1mL를 넣고 즉시 혼합하고 20±1℃의 항온수조에서 5분간 반응시킨다. 이 반응혼합액에서 1mL씩을 멸균 페트리접시 2매에 각각 넣고 상기 가. 4) (2)와 같이 배양한다. 중화제 독성 검증시험의 생균수(B)는 ① 시험조건 검증시험의 계산식에 따라 산정한다. 이 때, 중화제 독성 검증시험에서의 생균수(B)는 시험균주 현탁희석액에서 산정한 생균수(Nv)의 0.05배수 이상이어야 한다.
③ 희석중화 검증시험
시험관에 시험용액 8mL, 간섭물질 1mL 및 트립생톤리식염수 1mL를 넣고 즉시 혼합한 후 20±1℃의 항온수조에서 5분간 반응시킨다. 이 반응혼합액 1mL를 취하여 중화제 8mL가 담겨져 있는 시험관에 옮긴 후 20±1℃의 항온수조에서 5분간 반응시킨다. 이 중화 반응혼합액에 시험균주 현탁희석액 1mL를 첨가하여 혼합하고 20±1℃의 항온수조에서 30분간 반응시킨다. 이 액 1mL씩을 멸균 페트리접시 2매에 각각 넣고 상기 가. 4) (2)와 같이 배양한다. 희석중화 검증법의 생균수(C)는 ① 시험조건 검증시험의 계산식에 따라 산정한다. 이 때, 희석중화 검증시험에서의 생균수(C)는 중화제 독성시험법에서 산정한 생균수(B)의 0.5배수 이상이어야 한다.
7) 판정
다음 계산식에 따라 시험균의 생균수 감소율을 각각 계산하여 생균수 감소율이 99.999%이상일 때 적합한 것으로 본다.
 N : 시험균주 현탁액의 생균수(cfu/mL)
N : 시험균주 현탁액의 생균수(cfu/mL)
Na : 시험용액의 살균소독 작용에 의한 생균수*(cfu/mL)
* 본 시험에서 계수된 집락수가 15개 이하인 경우의 생균수(Na)는 “1.5×102 cfu/mL”를, 계수된 집락수가 300개 이상인 경우의 생균수(Na)는 “3×103 cfu/mL”를 각각 적용한다.
나. 세균표면시험법
본 시험방법은 간섭물질이 들어있는 시험균주 현탁액을 스테인리스 스틸 표면(담체)에 도말하여 건조시킨 후 이 막위에 시험용액을 처리하여 20±1℃에서 5분간 반응시키고 즉시 검증된 중화제를 사용하여 반응을 억제 시키는 방법으로 각 표면의 생균수를 측정하여 생균수 감소율을 측정하는 방법이다. 다만, 본 시험을 할 때에는 시험용액 대신 트립톤생리식염수를 사용하여 대조시험을 실시하고 검증시험을 동시에 수행하여야 한다.
1) 시험용액의 조제
시험용액은 검체에 표시된 사용농도에 맞게 경수로 희석하여 제조한다. 제조된 시험용액은 바로 사용하여야 하며, 최대 2시간을 초과하여 사용할 수 없다. 단, 희석하지 않고
그대로 사용하는 검체의 경우에는 원액을 그대로 사용한다.
2) 시험균주
가. 2)의 2가지 시험균주를 사용한다. 추가균주는 사용하지 않는다.
3) 시험균주의 배양
가. 3)에 따른다.
4) 시험균주 현탁액의 조제 및 계수
가. 4)에 따른다.
5) 시험표면 접종액의 조제
시험관에 시험균주 현탁액 400μL와 간섭물질 100μL를 첨가하여 1분간 교반기를 이용하여 잘 섞은 후 20±1℃의 항온수조에서 30분간 방치한 액을 시험표면 접종액으로 한다.
6) 시험표면의 조제
시험표면 접종액 10μL를 담체(라. 기구 및 재료 ⑦) 중앙에 접종하여 36±1℃로 조절된 가열판 위에서 건조시킨 것을 시험표면으로 한다.
7) 시험조작
시험용액, 시액, 기구 등은 20±1℃로 유지시킨다. 담체와 유리병(라. 기구 및 재료 ⑧)은 데시케이터(라. 기구 및 재료 ⑨)에 건조하여 준비한다.
(1) 본시험
시험표면을 멸균된 집게를 사용하여 시험표면 접종액의 건조된 표면이 위로 향하게 하여 유리병에 조심스럽게 넣는다. 유리병안의 시험표면 중앙에 시험용액 50μL를 첨가하고 20±1℃에서 5분간 반응응시킨 후 중화제 9.95mL와 유리비드 2 ~ 3g을 첨가하여 교반기에서 1분간 혼합하고 막여과장치(라. 기구 및 여과 재료 ⑩)로 여과한다.
여과 할 때 트립톤생리식염수 100 ~ 150mL를 2회 또는 3회 나누어 세척한다. 막여과장치로부터 여과막을 분리하여 상기 가. 6) (2) ①에 따라 배양한다. 상기 실험과정을
준비된 시험표면면으로 5회 반복한다. 본 시험의 생균수(Nd)를 다음 계산식에 따라 산정한다.
 c : 페트리접시에서 계수된 집락수의 합
c : 페트리접시에서 계수된 집락수의 합
n : 계수된 페트리접시의 수
d : 희석배수
따로 트립톤생리식염수를 사용하여 대조시험의 생균수(Nc)를 산정한다. 이 때, 반응혼합액은 트립톤생리식염수로 10-2, 10-3 및 10-4으로 희석하여 막여과장치로 여과하고 시험표면 반복횟수는 3회로 한다. 이때 대조시험의 생균수는 상기 나. 7) (1)의 계산식에 따라 산정할 때 1.5×105 cfu/carrier이상이어야 한다.
(2) 검증시험
① 중화 검증시험
유리병에 중화제 9.95mL와 시험용액 50μL를 넣고 혼합하여20±1℃에서 5분간 정치시킨 후 시험표면과 유리비드 2~3g을 첨가한다. 교반기에서 1분간 혼합한 후 반응혼합액 을 10-3, 10-4 및 10-5으로 희석하여 막여과장치로 여과한다. 여과할 때 희석액 100~150mL를 2회 또는 3회 나누어 세척한다. 막여과장치로부터 여과막을 분리하여 상기 가. 6) (2) ①에 따라 배양한다. 상기 기술된 실험과정을 따로 준비한 시험표면으로 2회 반복한다. 중화 검증시험의 생균수(A)를 상기 나. 7) ①의 계산식에 따라 산정한다. 이때 중화 검증시험의 생균수는 1.5×105 cfu/carrier이상이어야 한다.
② 중화제 독성 검증시험
유리병에 중화제 9.95mL와 시험용액 50μL를 넣고 혼합하여20±1℃에서 5분간 정치시킨 후 시험표면과 유리비드 2~3g을 첨가한다. 교반기에서 1분간 혼합한 후 반응혼합액을 10-3, 10-4 및 10-5으로 희석하여 막여과장치로 여과한다. 여과할 때 희석액 100~150mL를 2회 또는 3회 나누어 세척한다. 막여과장치로부터 여과막을 분리하여 상기 가. 6) (2) ①에 따라 배양한다. 상기 기술된 실험과정을 따로 준비한 시험표면으로 2회 반복한다. 중화제 독성 검증시험의 생균수(B)를 상기 나. 7) ①의 계산식에 따라 산정한다. 이때 중화제 독성 검증시험의 생균수는 중화 검증시험에서 산정한 생균수의 0.5배수 이상 ~ 2배수 이하이어야 한다.
8) 판정
다음 계산식에 따라 생균수 감소율이 99.99%이상일 때 적합한 것으로 본다.
 Nc : 대조시험의 생균수(cfu/carrier)
Nc : 대조시험의 생균수(cfu/carrier)
Nd : 시험용액의 살균소독 작용에 의한 생균수*(cfu/carrier)
* 본 시험에서 계수된 집락수가 15개 이하인 경우의 생균수(Nd)는 “1.5 ×10 cfu/carrier”를, 계수된 집락수가 300개 이상인 경우의 생균수(Nd)는 “3×102 cfu/carrier”를 각각 적용한다.
다. 포자현탁액시험법
1) 시험용액의 조제
시험용액은 검체에 표시된 사용농도보다 1.25배 높게 경수로 희석하여 제조한다. 제조된 시험용액은 바로 사용하며, 최대 2시간을 초과하여 사용할 수 없다.
단, 희석하지 않고 그대로 사용하는 검체의 경우에는 원액을 그대로 사용한다.
2) 시험균주
Bacillus subtilis ATCC 6633
3) 포자용액의 조제
시험균주를 TGB배지(마. 배지 ③)에 접종하고 30±1℃에서 18 ~ 24시간 배양한다. 이 배양액 2 ~ 3mL를 MYA배지(마. 배지 ④)를 넣어 굳힌 배양병(라. 기구 및 재료 ⑪)에
접종하여 30±1℃에서 8 ~ 10일간 배양한다. 멸균한 유리비드와 증류수를 사용하여 포자를 집균하고 10,000rpm에서 20분간 원심분리한다. 이후 상층액을 제거한 다음 다시
멸균 증류수에 부유시켜 세척하는 과정을 4회 반복하고 잔사를 멸균 증류수에 부유시켜 75±1℃에서 10분간 가열하여 포자용액을 조제한다.
조제된 포자용액은 냉장(5±1℃)보관 하여 사용하되 장기보관시에는 냉동보관한다.
4) 포자현탁액의 조제 및 계수
(1) 조제 : 상기 다. 3)의 포자용액을 멸균 증류수를 사용하여 1.5 X 106 ~ 5 X 106 cfu/mL로 조정하고 광학현미경(라. 기구 및 재료 ⑫)을 사용하여 영양세포가 없는 포자임을
확인하고, 20±1℃의 항온수조에서 방치한 액을 포자 현탁액으로 한다. 이 액은 제조 후 2시간 이내에 사용하여야 한다.
(2) 계수 : 포자 현탁액을 멸균 증류수로 10-4 ~ 10-5배 희석하고, 1mLㅆ씩을 멸균 패트리젒접시 2매에 각각 넣고 45±1℃로 유지한 GYA배지(마. 배지 ⑤)약 15mL를 무균적으로 분주하여 냉각응고 시킨 후 GYA 배지 3 ~ 5mL를 가하여 중첩시킨다. 냉각응고된 페트리접시를 거꾸로 하여 30±1℃에서 3일간 배양한 후 포자현탁액의 포자수(N)를 산정한다. 이 때, 포자현탁액의 포자수는 1.5 X 106 ~ 5 X 106 cfu/mL이어야 한다.
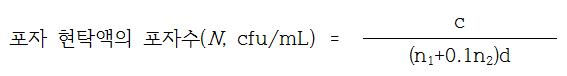
c : 페트리접시에서 계수된 집락수의 합
N1 : 첫 번째 희석에서 계수된 페트리접시의 수
N2 : 두 번째 희석에서 계수된 페트리접시의 수
d : 첫 번째 희석액의 희석배수
5) 포자현탁희석액의 조제 및 계수
(1) 조제 : 상기 다. 4)의 포자현탁액을 포자의 수가 6 X 102 ~ 3 X 103 cfu/mL가 되도록 멸균 증류수로 희석하여 조제한 액을 포자 현탁희석액으로 한다.
(2) 계수 : 포자 현탁희석액을 멸균 증류수로 10배 희석하고, 1mL씩 취하여 2매의 멸균 페트리접시에 각각 넣고 45±1℃로 유지한 GYA배지를 가하여 상기 다. 4) (2)와 같이
배양한다. 포자 현탁희석액의 포자수(Nv)는 다음의 계산식에 따라 산정한다. 이 때, 포자현탁희석액의 포자수(Nv)는 6 X 102 ~ 3 X 103 cfu/mL이어야 한다.
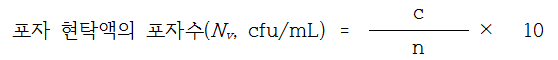
c : 페트리접시에서 계수된 집락수의 합
n : 계수된 페트리접시의 수
6) 시험조작
(1) 본시험
시험관에 간섭물질 1mL 및 포자현탁액 1mL를 첨가하여 즉시 혼합하고 20±1℃의 항온수조에서 2분간 방치한 후 시험용액 8mL를 첨가하여 혼합한 다음 20±1℃의 항온수조에 서 60분간 반응시킨다. 이 반응혼합액 1mL를 취하여 중화제 8mL와 멸균 증류수 1mL가 들어있는 시험관에 넣고 20±1℃의 항온수조에서 5분간 중화시킨다. 이 중화반응혼합액 1mL씩을 멸균 페트리접시 2매에 각각 넣고 상기 다. 4) (2)와 같이 GYA배지를 가하여 배양한다. 본 시험의 포자수(Na)를 상기 다. 5) (2)의 계산식에 따라 산정한다.단, 원액을 사용하는 검체는 시시험용액을 9.8mL 첨가하고, 간섭물질 및 포자 현탁액의 농도를 상기 사용한 농도보다 10배 높게 조제하여 각각 0.1mL씩 첨가하여 상기 시험조작과 동일하게 조작한다.
(2) 검증시험
검증시험에는 시험조건 검증시험, 중화제 독성 검증시험 및 희석중화 검증시험이 있으며, 이들 검증시험들은 상기 본시험과 같이 수행해야 한다.
① 시험조건 검증시험
시험관에 간섭물질 1mL와 포자현탁희석액 1mL를 첨가하여 즉시 혼합하고 20±1℃의 항온수조에서 2분간 방치하고 경수 8mL를 첨가하여 혼합한 후 20±1℃의 항온수조에서 \
60분간 반응시킨다. 이 반응혼합액에서 1mL씩을 멸균페트리 접시 2매에 각각 넣고 상기 다. 4) (2)와 같이 GYA배지를 가하여 배양한다. 시험조건 검증시험에서의 포자수(A)를
다음의 계산식에 따라 산정한다. 이 때, 시험조건 검증시험의 포자수(A)는 포자 현탁희석액 (Nv)의 0.05배수 이상이어야 한다.
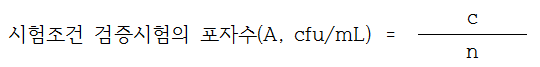
c : 페트리접시에서 계수된 집락수의 합
n : 계수된 페트리접시의 수
② 중화제 독성 검증시험
시험관에 중화제 8mL, 물 1mL 및 포자 현탁희석액 1mL를 넣고 수 초간 혼합한 후 20±1℃의 항온수조에서 5분간 반응시킨다. 이 반응혼합액에서 1mL씩을 멸균 페트리접시 2매에 각각 넣고 상기 다. 4) (2)와 같이 GYA배지를 가하여 배양한다. 중화제 독성 검증법의 포자수(B)를 상기 다. 6) (2) ① 시험조건 검증시험의 계산식에 따라 산정한다. 이 때, 중화제 독성 검증시험의 포자수(B)는 포자 현탁희석액 포자수(Nv)의 0.05배수 이상이어야 한다.
③ 희석중화 검증시험
시험관에 간섭물질 1mL, 물 1mL 및 시험용액 8mL를 넣고 수 초간 혼합한 후 20±1℃의 항온수조에서 60분간 반응시킨다. 이 반응혼합액 1mL를 취하여 중화제 8mL가 담겨져 있는 시험관에 옮긴 후 20±1℃의 항온수조에서 5분간 반응시킨다. 이 중화반응혼합액에 포자 현탁희석액 1mL를 첨가하여 혼합하고 20±1℃의 항온수조에서 30분간 반응킨 후 1mL씩 취하여 2매의 멸균 페트리접시에 각각 넣고 상기 다. 4) (2)와 같이 GYA배지를 가하여 배양한다. 희석중화 검증법의 포자수(C)를 다. 6) (2) ① 시험조건 검증시험의 계산식에 따라 산정한다. 이 때, 희석중화 검증시험의 포자수(C)는 포자 현탁희석액 포자수(Nv)의 0.05배수 이상이어야 한다.
7) 판정
다음 계산식에 따라 포자수 감소율(%)을 계산하여 포자수 감소율이 99.9%이상일 때 적합한 것으로 본다.
 N : 포자 현탁액의 포자수(cfu/mL)
Na : 본시험의 포자수*(cfu/mL)
N : 포자 현탁액의 포자수(cfu/mL)
Na : 본시험의 포자수*(cfu/mL)
* 본시험에서 계수된 집락수가 15개 이하인 경우의 생균수(Ns)는 “1.5×102 cfu/mL”를, 계수된 집락수가 300개 이상인 경우의 생균수(Nd)는 “3×103 cfu/mL”를 각각 적용한다.
라. 기구 및 재료
① 유리비드(glass bead, 직경 3~4mm)
② 교반기(stirrer), 기계식 교반기(Mixer)
③ 항온수조(water bath, 자동온도 조절기능 함유, 20±1℃)
④ 원심분리기(centriguger)
⑤ 페트리접시(petridish)
⑥ 시험관(test tube, 18 X 170mm 등)
⑦ 담체(carrier, ø 1cm X 0.07cm 스테인리스 스틸 디스크 ANSI 304 2B)
⑧ 유리병(바닥 지름 2 ~ 3cm, 용량 15 ~ 20mL)
⑨ 데시케이터(desicator)
⑩ 막여과장치(여과막 지름 : 47 ~ 50mm pore size : 0.45μm, 최소 50mL의 용액을 담을 수 있어야 함, 진공 사용시 균일한 여과율로 세척액 100mL가 20 ~ 40초 사이에 여과될 수 있도록 설계된 장치 사용)
⑪ 배양병(roux bottle, 500mL)
⑫ 광학현미경(optical microscope)
⑬ 무균대(clean bench)
⑭ 고압멸균기(autoclave)
⑮ 건조기(dry oven)
⑯ 배양기(incubator, 36±1℃와 30±1℃)
⑰ 냉동 및 냉장고(-70℃ freezer 포함)
⑱초순수 제조장치(ultra pure water system)
⑲집락계산기(colony counter)
⑳수소이온농도측정기(pH meter)
㉑ 피펫(1mL, 5mL, 10mL 등)
㉒ 슬라이드/커버 글라라스
㉓ 알콜램프, 백금이, 백금선 등
마. 배지
본 실험을 위한 배지조제시 이미 상품화된 배지의 사용이 가능하며, 사용할 각 제조사별 조제법을 따를 수 있다.
① TSA배지(tryptone soya agar)
Tryptone, pancreatic digest of casein
15.0g
Soya peptone, papaic digest of soybean meal
5.0g
NaCl
5.0g
Agar
15.0g
위의 성분을 증류수 1,000mL에 녹여 pH 7.2±0.2로 조정한 후 121℃에서 15분간 멸균한다.
② TSB배지(tryptone soya broth)
Tryptone, pancreatic digest of casein
15.0g
Soya peptone, papaic digest of soybean meal
5.0g
NaCl
5.0g
위의 성분을 증류수 1,000mL에 녹여 pH 7.2로 조정한 후 121℃에서 15분간 멸균한다.
③ TGB배지(tryptone glucose broth)
Yeast Extract
2.5g
Tryptone
5.0g
Glucose
1.0g
위의 성분을 증류수 1,000mL에 녹여 pH 7.2±0.2로 조정한 후 121℃에서 15분간 멸균한다.
④ MYA배지(yeast extract agar)
Meat Extract
10.0g
Yeast Extract
2.0g
MnSO4·H2O
0.04g
Agar
15.0g
위의 성분을 증류수 1,000mL에 녹여 pH 7.0±0.2로 조정한 후 121℃에서 15분간 멸균한다.
⑤ GYA배지(glucose yeast extract agar)
Amino Acids, acid hydrolysis of casein
1.0g
Soluble Strach
1.0g
Glucose
2.5g
Yeast Extract
2.5g
FeSO4
0.1g
MnSO4·H2O
0.0001g
Agar
15.0g
위의 성분을 증류수 1,000mL에 녹여 pH 6.8±0.2로 조정한 후 121℃에서 15분간 멸균한다.
바. 시액
① 트립톤생리식염수(tryptone sodium chloride solution)
Tryptone, pancreatic digest of casein
1.0g
NaCl
8.5g
위의 성분을 증류수 1,000mL에 녹여 pH 7.2±0.2로 조정한 후 121℃에서 15분간 멸균한다.
② 경수(hard water)
- 용액 A : 19.84g의 염화마그네슘(MgCl2)과 46.24g 의 염화칼슘(CaCl2)을 증류수에 용해항하여 1L로 맞춘다. 이 용액은 냉장보관하여 최대 1개월 간 사용할 수 있다.
- 용액 B : 35.02g의 탄산수소나트륨(NaHCO3)을 증류수로 용해하여 1,000mL로 맞춘다. 이 용액은 냉장보관하여 최대 1주일 간 사용할 수 있다.
1,000mL의 메스플ㄹ라스크에 용액 A 3.0mL를 넣고 최소 600mL의 증류수를 가해주고, 용액 B 8.0mL를 가해준 후 증류수를 가하여 1,000mL로 한다.
용액의 pH를 7.0±0.2로 조정하고 여과 멸균한다. 이 혼합 용액은 12시간 이내에 사용하여야 한다.
③ 간섭물질(interfering substance)
0.3g의 알부민(bovine albumin fraction V)을 증류수 100mL에 녹이고 여과 멸균한다. 본 간섭물질이 시험용액과 반응하여 침전이 발생할 경우에는 적절한 다른
간섭물질을 사용하여 실험할 수 있으며, 이 때 사용한 간섭물질은 본 간섭물질과 동일한 간섭효과를 가져야 한다.
④ 중화제(neutralizer)
레시틴(lecithin)
3g
폴리소르베이트 80(polysorbate 80)
30g
치오설페이트염(sodium thiosulfate)
5g
히스티딘(L-histidine)
1g
사포닌(saponine)
30g
위의 성분을 트립톤생리식염수를 가하여 1,000mL로 하고 pH 7.2±0.2로 조정한 후 121℃에서 15분간 멸균한다.
본 중화제 이외에 검증시험에서 유효성이 검증된 다른 중화제를 사용할수도 있다.
n1 : 10-6 희석에서 계수된 페트리접시의 수
n2 : 10-7 희석에서 계수된 페트리접시의 수
d : 첫 번째 희석액의 희석배수(10-6)
n : 계수된 페트리접시의 수
Na : 시험용액의 살균소독 작용에 의한 생균수*(cfu/mL)
n : 계수된 페트리접시의 수
d : 희석배수

Nd : 시험용액의 살균소독 작용에 의한 생균수*(cfu/carrier)
